CANCERS VÉGÉTAUX, CANCERS ANIMAUX
Aux expériences sur les ADN d'origine animale répondent des recherches sur les ADN des végétaux.
Beljanski et ses collaborateurs vont comparer in vitro l'action de l'auxine, hormone de
croissance, à celle de la kinétine, hormone de division, au niveau de trois types d'ADN,
normal,
anergié et cancéreux, provenant de plusieurs espèces de plantes.
Avant l' addition d'hormones dans le milieu d'incubation, la mesure de 1'ADN
synthétisé in
vitro montre que 1'ADN de crown-gall est une matrice plus efficace que 1'ADN des tissus
anergiés, lequel, à son tour, se réplique plus fortement que celui des tissus sains.
Les mesures
d'hyperchromicité confirrnent que la déstabilisation de ces trois types d'ADN va
exactement
de pair avec leur capacité matricielle, comme c' est le cas pour les ADN d' animaux.
Ajoutée au milieu d'incubation, l'auxine stimule très fortement la synthèse de 1'ADN
de
crown-gall et la séparation de ses chaînes (hyperchromicité); un peu moins fortement la
synthèse et la séparation des chaînes de 1'ADN des tissus anergiés; très peu la
synthèse et la
séparation des chaînes de 1'ADN normal.
La kinétine a des effets exactement inverses: elle entrave fortement l'ouverture des
chaînes et
la synthèse de 1'ADN de crown-gall, moins fortement celles de 1'ADN des tissus anergiés,
beaucoup moins fortement celles de l'ADN des tissus normaux. L'inhibition qu'elle exerce
est
particulièrement nette lorsque les chaînes d'ADN ont été d'abord ouvertes par
l'auxine'l'.
La régulation de la cellule végétale en fonction de ses besoins fait entrer en
compétition ces
deux hormones aux effets contraires. L'activité observée pour la kinétine porte à
penser qu'à
certaines doses, cette molécule pourrait se comporter comme un anticancéreux vis-à-vis
des
tumeurs de crown-gall; des résultats préliminaires tendent à le démontrer.
Beljanski et ses collaborateurs ont fait de nombreuses expériences qui prouvent que
l'activité in
vivo des cancérogènes sur les cellules tumorales correspond parfaitement à leurs effets
in vitro.
De même que ces composés, in vitro, déstabilisent 1'ADN cancéreux et en augmentent
la
synthèse, ils stimulent in vivo la réplication des ADN cancéreux. Au-delà de certaines
concentrations, cependant, ils peuvent, comme les antimitotiques, tuer les cellules en
déstabilisant leur ADN au point que toute coordination du fonctionnement des gènes
devient
impossible.
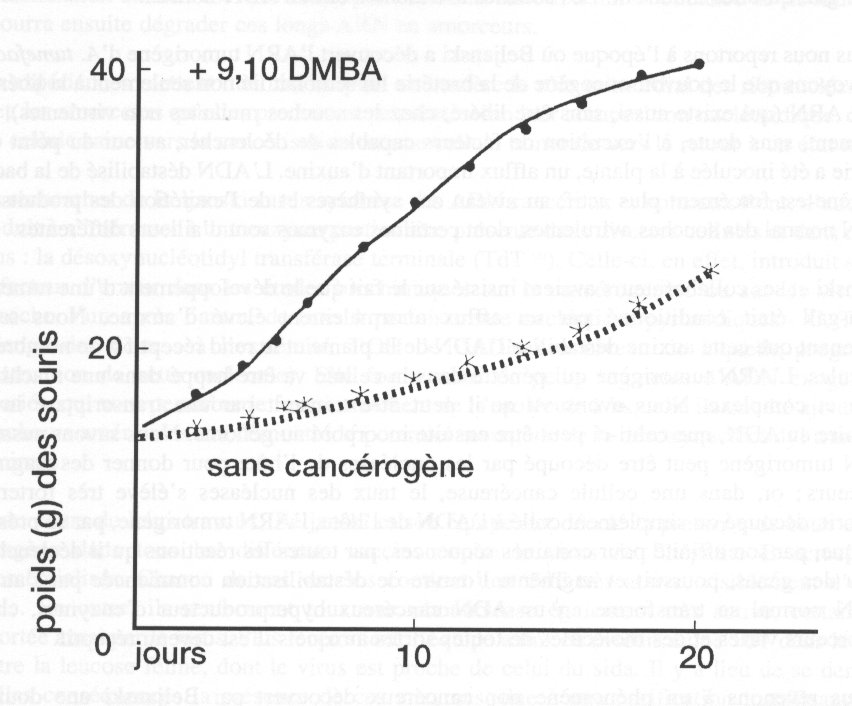
Pour démontrer la corrélation entre les effets in vitro et in vivo des
cancérogènes, l'équipe a
suivi l'action du DMBA (9,10-diméthylbenz (a) anthracène) sur le développement de
tumeurs
solides (ascites d'Ehrlich) chez la souris. De faibles doses de DMBA ont été injectées
quotidiennement dans la région de la tumeur, pendant plusieurs jours consécutifs. Le
poids des
tumeurs a augmenté rapidement; vers le vingtième jour, il était environ trois fois plus
élevé que
celui des ascites des souris témoins.
Dans une autre expérience, des souris porteuses d'ascites d'Ehrlich ont reçu de
faibles doses
d'un antimitotique, le CCNU, également injectées dans la zone de la tumeur. Le nombre de
cellules tumorales, chez les souris traitées, est deux fois plus élevé que chez les
animaux non
(1) La kinétine stimule la division de la cellule végétale, dont la synthèse d'ADN
n'est que la première phase; I'effet
de cette hormone de division s'exerce au cours d'une étape suivante.
traités. Ainsi, in vivo comme dans l'oncotest, l'antimitotique s'est comporté, à
faibles doses,
comme un cancérogène.
< IMG_P51.JPG >

Stimulation par le. DMA (diméthylbenzanthracène) de la multiplication
des cellules ascitiques d'Ehrlich chez les souris (réf.88).
Trait plein: multiplication en présence du DMBA.
Trait pointillé: multiplication en l'absence du DMBA.
Des expériences similaires ont été effectuées sur des plantes. L'équipe avait
déjà montré,
rappelons-le, par les mêmes méthodes que pour le règne animal (incubation in vitro et
mesure de
1'ADN synthétisé, évaluation de l'hyperchromicité), que 1'ADN cancéreux des plantes
(crown-
gall) se comporte en meilleure matrice que 1'ADN des tissus normaux et qu'il est
déstabilisé.
Elle a prouvé, en outre, au cours d'expériences sur le pois, que des molécules
cancérogènes
chez les animaux, comme le DMBA ou l'éthionine, exercent un effet très marqué sur les
tumeurs de crown-gall. In vitro, ils stimulent la séparation des châînes et la
synthèse d'ADN
tumoral, mais n'agissent que très faiblement sur 1'ADN normal. In vivo, lorsqu'ils sont
utilisés
à doses faibles ou modérées, ils accroissent la multiplication des cellules de
crown-gall. A
fortes doses, cependant, ils inhibent le développement de ces tumeurs, parce qu'ils en
tuent les
cellules en déstabilisant à l'excès leur ADN, ce qui, nous 1' avons indiqué plus haut,
interdit tout
fonctionnement coordonné des gènes et favorise les cassures des brins d'ADN.
Comme c'est le cas chez les cellules animales, des antimitotiques tels que le
cyclophosphamide, la daunorubicine ou la mitomycine ont chez les végétaux, in vitro et
in vivo,
une action cancérogène lorsqu'ils sont utilisés à faible dose.
D'autres travaux de l'équipe ont mis en lumière un fait intéressant: les souches
oncogènes
d'Agrobacterium tumefaciens possèdent un ADN déstabilisé, comme celui des tumeurs de
crown-gall qu'elles induisent. Les souches avirulentes ont un ADN normal.
Si nous nous reportons à l'époque où Beljanski a découvert 1'ARN tumorigène d'A.
tumefaciens,
nous voyons que le pouvoir oncogène de la bactérie lui semblait lié non seulement à la
libération
de cet ARN (qui existe aussi, sans être libéré, chez les souches mutantes non
virulentes), mais
également, sans doute, à l'excrétion de facteurs capables de déclencher, autour du
point où la
bactérie a été inoculée à la plante, un afflux important d' auxine. L' ADN
déstabilisé de la bactérie
oncogène est forcément plus actif, au niveau des synthèses et de l'excrétion des
produits, que
1'ADN normal des souches avirulentes, dont certaines enzymes sont d'ailleurs différentes.
Beljanski et ses collaborateurs avaient insisté sur le fait que le développement
d'une tumeur de
crown-gall était conditionné par un afflux anormalement élevé d' auxine. Nous savons
maintenant que cette auxine déstabilise 1'ADN de la plante et le rend réceptif à de
nombreuses
molécules. L'ARN tumorigène qui pénètre dans la cellule va être happé dans une
machinerie
rapide et complexe. Nous avons vu qu'il peut être transcrit par une transcriptase inverse
cellulaire en ADN, que celui-ci peut être ensuite incorporé au génome. Nous savons
aussi que
1'ARN tumorigène peut être découpé par les nucléases de l'hôte pour donner des
fragments
amorceurs; or, dans une cellule cancéreuse, le taux des nucléases s'élève très
fortement.
Transcrit, découpé ou simplement collé à 1'ADN de l'hôte, 1'ARN tumorigène, par sa
présence
physique, par son affinité pour certaines séquences, par toutes le
s réactions qu'il déclenche au
niveau des gènes, poursuit et augmente l'œuvre de déstabilisation commencée par
l'auxine.
L' ADN normal se transforme en un ADN cancéreux hyperproducteur d' enzymes, chargé
d'amorceurs variés et des molécules de toutes sortes auxquels il est devenu réceptif.
Si nous revenons à un phénomène non cancéreux découvert par Beljanski une douzaine
d'années avant les travaux sur la déstabilisation de 1'ADN: la modification de souches
bactériennes par la showdomycine, puis par l'ARN transformant, nous voyons que la
multiplication accrue des mutants peut être expliquée par une structure plus lâche de
leur ADN.
La cause en est complexe et, ici encore, met en jeu plusieurs processus intracellulaires.
I1 nous faut mentionner ici également les expériences effectuées, en collaboration
avec S.K.
Dutta (Etats-Unis), sur un curieux mutant de Neurospora crassa, champignon microscopique
(moisissure) classiquement utilisé au laboratoire. Pendant une phase dite de latence, ce
champignon synthétise d'innombrables molécules d'ARN ribosomique, dont l'utilité ne se
comprend pas de prime abord. Cependant, dès que débute la multiplication cellulaire, cet
ARN
disparaît, tandis que sont excrétés dans le milieu de culture des ARN extrêmement
courts (10
à 12 nucléotides) contenant exclusivement des bases puriques. In vitro, ces ARN, qui se
comportent en amorceurs, stimulent très fortement la réplication de 1'ADN du champignon
mutant, mais pas celle de 1'ADN de la souche sauvage.
Ces amorceurs sont également capables d'accélérer fortement, in vitro, la synthèse
de divers
ADN cancéreux humains, mais non celle des ADN normaux correspondants. Parallèlement, la
réplication de 1'ADN du champignon mutant, mais non celle de 1'ADN de la souche sauvage,
est grandement stimulée par les cancérogènes. L'ADN du mutant est donc déstabilisé;
il
présente de trop nombreux sites d'initiation. C' est pourquoi il a besoin, pour se
répliquer, d'une
quantité élevée d'amorceurs spécifiques.
Pour les obtenir, le mutant va suivre la même méthode que Beljanski - ce qui montre
bien
qu'elle représente un processus physiologique, naturel: il va synthétiser un excès
d'ARN
ribosomiques, par une transcription excessive des gènes correspondants, que permet la
déstabilisation de son ADN; et muni, pour la même raison, d'une abondance de
ribonucléases,
il pourra ensuite dégrader ces longs ARN en amorceurs.
Ces expériences mettent une fois de plus en lumière le rôle primordial des
ribonucléases: en
effet, les amorceurs qu'elles produisent peuvent, selon leur composition nucléotidique,
orienter
une cellule saine vers la cancérisation ou une cellule tumorale vers le retour à un
état normal.
Les recherches de Beljanski sur la synthèse des ADN cancéreux et normaux l'ont,
d'autre part,
conduit à s'intéresser à une enzyme particulière présente dans diverses cellules et
dans certains
virus: la désoxynucléotidyl transférase terminale (TdT (2)). Celle-ci, en effet,
introduit souvent
un facteur d'erreur dans les études biochimiques sur la cancérogenèse ou sur les virus.
Elle
accroche, l'un après l'autre, de trois à parfois trente nucléotides pyrimidiques - C, T
ou un
mélange des deux - à l'extrémité 3'0H de 1'ADN (au niveau de laquelle progresse la
construction de cette molécule). Elle forme ainsi de petits segments d'ADN exogène non
appariés, qui vont perturber le fonctionnement de la molécule à laquelle ils ont été
ajoutés. Des
chercheurs américains ont démontré le potentiel mutagène de la désoxynucléotidyl
transférase
terminale.
Or, au cours de leurs travaux, Beljanski et son équipe ont décelé la présence de
cette enzyme
mutagène dans tous les différents vaccins contre le virus de l'hépatite B actuellement
commercialisés. Chacun de ces vaccins contient une TdT très active, visiblement
d'origine
virale. En outre, ils renferment tous une ribonucléase également très active,
certainement
apportée aussi par le virus. Plus récemment, l'équipe a mis en évidence une TdT dans
le vaccin
contre la leucose féline, dont le virus est proche de celui du sida. I1 y a lieu de se
demander
quelles conséquences la présence de ces enzymes, due à une purification insuffisante,
peut
avoir pour le sujet vacciné.
Si la déstabilisation de 1'ADN apparâît comme la condition nécessaire de la
cancérisation, elle
intervient néanmoins, nous 1' avons vu, dans des processus non cancéreux, tels que la
multiplication et la différenciation cellulaires normales ou la création de souches
bactériennes
nouvelles par les ARN transformants. Mais elle est. dans ce cas, limitée, localisée.
La cancérisation fait intervenir, à la suite de la déstabilisation de 1'ADN,
d'autres phénomènes
qui en découlent et l'amplifient. La fixation de molécules endogènes ou d'origine
extérieure y
apporte une contribution déterminante, et, vue sous cet angle, la cancérisation est
liée à
l'environnement au sens large, interne aussi bien qu'externe. La production anormale
d'enzymes par 1'ADN déstabilisé joue un rôle primordial; le fort excédent de
nucléases, qui
caractérise le développement des cancers, permet notamment à la cellule malade de
fabriquer,
avec ses ribonucléases, une grande quantité d'amorceurs, qui vont intensifier sa
multiplication.
La cellule saine peut opposer à l' installation de ces phénomènes néfastes les
mécanismes
régulateurs dont elle dispose. La lutte est sévère et la transformation d'une
déstabilisation
limitée de 1'ADN en une cancérisation caractérisée dépend de nombreux facteurs, dont
deux
sont primordiaux: la sensibilité de la cellule aux agents déstabilisants, conditionnée
par l'état
de ses défenses naturelles, et l'apport de substances dangereuses par son environnement,
externe ou interne.
(2) Terminal deoxynucleotidyl tranferase
Les nombreuses expériences que nous avons décrites, qu'elles soient menées sur des
cellules
animales ou végétales, appellent à réfléchir sur l'extrême importance de la
concentration des
produits employés.
Nous avons ainsi vu qu'une même substance peut se comporter en antimitotique, tuant
les
cellules en division rapide, ou en cancérogène, favorisant la croissance des tumeurs
qu'elle est
censée combattre, selon qu'elle est utilisée à des concentrations fortes ou faibles.
Des hormones comme les auxines végétales ou les hormones stéroïdes des mammifères
accomplissent une tâche nécessaire lorsqu'elles sont présentes à des doses
physiologiques,
c'est-à-dire relativement faibles, mais favorisent l'apparition de tumeurs lorsqu'elles
sont
administrées à des doses anormalement élevées.
La notion de concentration se retrouve dans tous les processus biologiques et, dans
bien des cas,
l'effet d'une dose importante d'un produit est. comme ici, l'inverse de celui d'une dose
faible.
RÉSUMÉ
Beljanski démontre que la déstabilisation de l'ADN caractérise aussi bien les tissus
cancéreux des plantes que ceux des animaux.
L'équipe met en évidence les propriétés déstabilisantes des auxines. Dans
l'Oncotest,
ces hormones de croissance végétales activent spécifiquement la réplication de
l'ADN cancéreux. La kinétine, hormone qui intervient dans une autre phase de la
division des cellules végétales, a des effets exactement contraires: elle entrave
l'ouverture des châînes d'ADN.
Beljanski prouve que les effets in vivo des cancérogènes ainsi que de faibles doses
d'antimitotiques, chez l'animal comme chez les plantes, correspondent bien à leur
action sur l'ADN in vitro.
D'autre part, il prouve que l'ADN des souches cancérogènes d'A. tumefaciens est
déstabilisé; ainsi, plus actif que l'ADN des souches non virulentes, il peut libérer
l'ARN tumorigène et divers facteurs capables de déclencher un afflux d'auxine, dont
la présence préalable est indispensable pour commencer à déstabiliser l'ADN de la
cellule végétale et le rendre réceptif à l'ARN tumorigène.
La cancérisation débute par une déstabilisation de l'ADN, permanente et plus
étendue
qu'au cours des processus normaux de la multiplication et de la différenciation
cellulaires, pendant lesquels les brins s'écartent localement de façon transitoire. Mais
ensuite, cette déstabilisation est amplifiée par des phénomènes qui en découlent:
fixation de molécules venues de l'environnement interne ou extérieur, production
anormale d' enzymes, en particulier d' une abondance de nucléases capables de
fabriquer des amorceurs qui intensifient la multiplication des cellules tumorales.
La cellule saine possède des mécanismes régulateurs pour se défendre contre la
cancérisation. Aussi le passage d'une déstabilisation limitée de l'ADN à une
cancérisation caractérisée dépend-il, en particulier, de l'état des défenses
naturelles
cellulaires et de l'apport de substances dangereuses par l'environnement au sens
large. L'effet de ces substances est lié dans une large mesure à leur concentration.